Bijna alle eigenaars van een persoonlijk voertuig weten heel goed dat de batterijen zuur zijn. Zelfs beginners die net beginnen met het begrijpen van de basisprincipes van het rijden, en zich zelfs bewust zijn van dit probleem.
Velen van hen hebben gehoord over loodzuurbatterijen, maar in werkelijkheid hebben ze geen idee hoe dit apparaat werkt. Ondertussen vinden hier bepaalde chemische reacties plaats.
Sodrezhanie
Welk zuur zit er in de batterij en waarvoor dient het?
De meeste automobilisten zijn zich terdege bewust van het zuur in de batterij. Maar er zijn mensen die geloven dat er in de batterij niets anders zit dan gedestilleerd water (of destillaat). Anderen zijn voorstander van zoutzuur, wat ook onjuist is.
Elke autobatterij bevat zwavelzuur - H2SO4. Om precies te zijn, we hebben het over een oplossing van zwavelzuur met gedestilleerd water. Zo'n vloeistof heeft een gemeenschappelijke naam - elektrolyt. Dus wat is de rol van zwavelzuur?
Dit is het hoofdonderdeel voor batterijvoeding. Bij afwezigheid van zuur is het laden en ontladen van de batterij niet mogelijk. Dit is een van de meest actieve soorten, die in staat is om te communiceren met vrijwel elk metaal, inclusief hun oxiden. Bovendien kan het zuur metabole reacties aangaan en hangt de activiteit ervan af van het watergehalte.
Wanneer de zuurbatterij wordt opgeladen, beginnen zuivere loodplaten (negatief) elektronen af te geven die worden opgenomen door loodoxideroosters (positief). Wanneer de batterij leeg is, gebeurt het precies andersom. Met andere woorden, wanneer de platen de elektronen weggeven, worden ze als het ware 'vernietigd' - er treedt een lading op en wanneer ze worden ontladen, komen ze terug, wat 'herstel' wordt genoemd.
En juist voor een dergelijk proces van vernietiging - herstel, is een agressieve omgeving nodig in de vorm van verdund zwavelzuur. En zonder dat zouden de prestaties van autobatterijen op een zeer laag niveau zijn.
De samenstelling van de elektrolyt en hoe het goed te doen
Zwavelzuur wordt veel gebruikt in de moderne industrie om elektrische energie te produceren (batterijen, batterijen, elektrische condensatoren). Wat de samenstelling van de elektrolyt in de batterij betreft, is de verhouding tussen zwavelzuur en gedestilleerd water als volgt:
- zuur zelf - 30%;
- gedestilleerd water - 70%.
Het is zo'n substantie die effectief samenwerkt met loodplaten. In dit geval verdient de elektrolytdichtheid speciale aandacht, die rechtstreeks wordt beïnvloed door zwavelzuur. Geconcentreerd bereikt het een indicator van 1,83 g / cm3. Door gedistilleerd water toe te voegen, wordt de dichtheid verlaagd tot de gewenste limieten - meestal is dit een bereik van 1,23-1,27 g / cm3.
| dichtheid elektrolyt (g / cm3) | voltage geen lading (B) | voltage met lading (B) | Mate van lading (%) | ijskoud elektrolyt (C) |
|---|---|---|---|---|
| 1,27 | 12,66 | 10,8 | 100 | -60 |
| 1,26 | 12,6 | 10,66 | 94 | -55 |
| 1,25 | 12,54 | 10,5 | 87,5 | -50 |
| 1,24 | 12,48 | 10,34 | 81 | -46 |
| 1,23 | 12,42 | 10,2 | 75 | -42 |
| 1,22 | 12,36 | 10,06 | 69 | -37 |
| 1,21 | 12,3 | 9,9 | 62,5 | -32 |
| 1,2 | 12,24 | 9,74 | 56 | -27 |
| 1,19 | 12,18 | 9,6 | 50 | -24 |
| 1,18 | 12,12 | 9,46 | 44 | -18 |
| 1,17 | 12,06 | 9,3 | 37,5 | -16 |
| 1,16 | 12 | 9,14 | 31 | -14 |
| 1,15 | 11,94 | 9 | 25 | -13 |
| 1,14 | 11,88 | 8,84 | 19 | -11 |
| 1,13 | 11,82 | 8,68 | 12,56 | -9 |
| 1,12 | 11,76 | 8,54 | 6 | -8 |
| 1,11 | 11,7 | 8,4 | 0,0 | -7 |
Om deze parameter te kennen, is het noodzakelijk om de vriesdrempel van de elektrolyt te begrijpen. Bij een dichtheid van 1,11 g / cm3 de stof bevriest al onder invloed van een relatief kleine verkoudheid: -7 ° C. Voor aanbevolen waarden is deze drempel aanzienlijk verschillend - van -58 ° C tot -64 ° C. Is het mogelijk om zelf een elektrolyt te maken?
Ja, het is echt mogelijk, alleen is het noodzakelijk om met uiterste zorg te handelen. En omdat het noodzakelijk is om te gaan met zwavelzuur van hoge concentratie, vormt dergelijk werk een zeker gevaar. Het is noodzakelijk om te zorgen voor de bescherming van de handen, lichaam, ademhalingsorganen.
Eigenlijk is er niets ingewikkelds bij het onafhankelijk bereiden van de elektrolyt voor de batterij - meng zwavelzuur met gedestilleerd water en let op de verhouding. Het is vermeldenswaard dat gewoon kraanwater niet geschikt is voor dergelijke doeleinden, omdat het een groot aantal verschillende onzuiverheden bevat die loodplaten nadelig beïnvloeden.
Eigenlijk de ingrediënten zelf:
- Zwavelzuur (dichtheid moet 1,83 g / cm zijn3 of meer, maar niet minder).
- Gedestilleerd water
- Elk porselein.
De verhoudingen van zuur en water zijn ons bekend - respectievelijk 30% en 70%. Tegelijkertijd is de aard van de benadering van productie belangrijk - het is optimaal om zuur aan water toe te voegen, en niet andersom. Het is ook de moeite waard om te overwegen dat bij het mengen ervan veel thermische energie wordt vrijgegeven en om deze reden het onaanvaardbaar is om glaswerk te gebruiken - het barst gewoon. Wanneer de temperatuur van het elektrolyt daalt, kan het in een glazen container of container van plastic worden gegoten.
Nadat de vloeistoffen zijn aangesloten, moet de dichtheid worden gemeten met een hydrometer. Als de indicatoren overeenkomen met de toelaatbare limiet, is het elektrolyt klaar voor gebruik. Maar een dergelijk apparaat is verre van elke driver en daarom is de volgende tip van de elektrolytdichtheid nuttig (gebaseerd op 1 liter gedestilleerd water):
- bij 1,23 g / cm3 - 280 g;
- bij 1,25 g / cm3 - 310 g;
- bij 1,27 g / cm3 - 345 g;
- bij 1,29 g / cm3 - 385 g.
Eigenlijk is dit waar het werk eindigt. Degenen die in de middelste zone van Rusland wonen, moeten zich houden aan een dichtheid van 1,27 g / cm3. Voor gebieden met een koud klimaat (tot -30 ° C) is de toegestane indicator bovendien 1,26-1,28 g / cm3en hete subtropische gebieden - 1,24-1,26 g / cm3. Dichtheidslimieten van 1,27 g / cm3 tot 1,29 g / cm3 relevant voor die regio's waar de winter ongebreideld is tot -50 ° C.
Wat zal leiden tot een inbreuk
1,29 g / cm3 is niet de hoogste - er is een elektrolytconcentraat met een dichtheid van 1,33 g / cm3 (gebruikt voor aanpassing), eerder kon zelfs worden gevonden met een dichtheid van 1,4 g / cm3maar nu is het uitverkocht. Het moet echter ook worden verdund met water en pas daarna in de batterij worden gevuld. Waarom geen sterk geconcentreerde elektrolyt gieten?
Er zal zeker niets goeds gebeuren! Vanwege de hoge concentratie lijden de batterijplaten - ze corroderen eenvoudig na verloop van tijd. Dit is langzaam maar waar! Daarom, als u een hoog concentraat giet, moet u niet verbaasd zijn dat de batterij snel uitviel.
Lage elektrolytdichtheid leidt tot een fenomeen dat sulfatie wordt genoemd. Dit proces is bij veel ervaren chauffeurs bekend. Als resultaat worden loodsulfietkristallen op de platen afgezet, waardoor het metaal zijn vermogen om lading te accumuleren verliest.
Bovendien, zoals hierboven reeds vermeld, bevriest de elektrolyt als gevolg van te lage dichtheidsindicatoren en verandert in ijs. Wat dit bedreigt, begrijpt iedereen al - schade aan de platen kan niet worden vermeden.
Hoe de vloeistofdichtheid aan te passen
Autobezitters moeten het elektrolytniveau en de dichtheid ervan regelen. Door de hydrolyse en verwarming van de accu's in de motorruimte neemt het gehalte van de stof af, terwijl de dichtheid daarentegen toeneemt. Om deze reden moet gedistilleerd water worden toegevoegd. Maar soms kan de dichtheid van de elektrolyt minder worden dan normaal. Dan moet u de zuurconcentratie verhogen.
Er zijn verschillende manieren om dit te doen, gebaseerd op de mate van afname van de elektrolytdichtheid. Om dit te doen, moet u de concentratie in elke bank afzonderlijk meten. Als de elektrolytdichtheid wordt verkregen vanaf 1,18 g / cm3 tot 1,20 g / cm3, dan is de optimale oplossing om een deel van de elektrolyt in de bank te vervangen door een nieuwe met een dichtheid van 1,27 g / cm3. Met andere woorden, er wordt een toename van de dichtheid van de elektrolyt gemaakt.
Alleen u moet eerst controleren of de batterij is opgeladen, anders moet de batterij worden opgeladen. Met een lege batterij kan deze procedure niet worden gestart.Anders is de concentratie van H2SO4 stijgt scherp, wat alleen zal leiden tot de vernietiging van de platen.
De procedure zelf wordt uitgevoerd in de volgende volgorde:
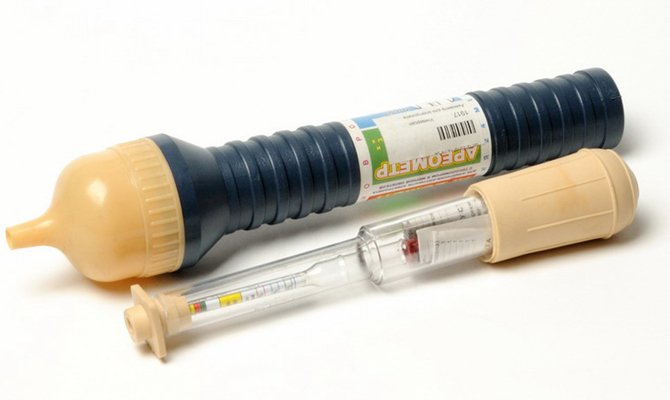
- Pomp met een rubberen bol zoveel mogelijk vloeistof uit het blik. Meet tegelijkertijd het volume.
- Een nieuwe correctievloeistof met een dichtheid van 1,27-1,29 g / cm3 wordt toegevoegd in een hoeveelheid gelijk aan de helft van het onttrokken volume.
- Laat alles met elkaar vermengen - hiervoor kun je een lading geven aan de conclusies, even wachten of de batterij schudden.
- Meet de dichtheid. Als de indicatoren de toelaatbare limieten nog steeds niet hebben bereikt, moet het bijvullen van elektrolyt worden voortgezet totdat de gewenste parameters zijn bereikt.
- Wanneer de limiet is ingesteld, worden de banken gesloten en wordt de batterij zelf opgeladen.
In het geval dat de dichtheid van de elektrolyt wordt verlaagd tot beneden het niveau van 1,2 g / cm3, is het noodzakelijk om deze volledig te wijzigen - voeg de oude samen, vul een nieuwe in.